隨著我*經濟的高速發展, 工礦企業產生的廢
水呈現出高濃度
〔1〕、難生物降解
〔2〕和水質復雜
〔3〕等特點, 傳統的生化處理方法已很難達到相應的排放標準要求。 近十幾年興起的**氧化技術能高效降解污染物或提高廢水的可生化性
〔4〕,因而受到人們的關注。 其中,活化氧化劑(H
2O
2、O
3 等)產生羥基自由
基(·OH),活化過硫酸鹽產生硫酸根自由基(SO·
-)
4
的作用機理成為當前研究的熱點。
COD 可反映廢水中有機物的相對含量,還原性無機物質對 COD 的測定有影響。 廢水體系中殘留的無機活化物質
〔5〕會導致 COD 測定值偏高或混淆滴定終點。過硫酸鹽作為一種氧化性物質,在遇到氧化性更強的物質如重鉻酸鉀時則充當還原劑。 因此在
COD 測定過程中,殘留的過硫酸鹽作為還原性物質與重鉻酸鉀反應,會引起 COD 測定誤差。 若加入掩蔽劑如高錳酸鉀、 硫代硫酸鈉和亞硫酸鉀等可以消除其干擾,但剩余的掩蔽劑又形成新的干擾。 因此,尋找一種簡單、快速、可靠的方法來消除過硫酸鹽以
準確測定 COD 是十分必要的。 筆者考察了過硫酸鹽
(過硫酸鉀)對 COD 測定的干擾,分析產生干擾的原因,并提出消除干擾的措施,為準確測定廢水 COD
提供依據。
1 實驗部分
1.1 主要儀器與試劑
儀 器:DR200 型
消解器(美* HACH 公司),帶
聚四氟乙烯蓋的消解管(50 mL),N/C2100 型 TOC
分析儀(德*耶拿公司),MIC 型離子色譜儀(瑞士萬通公司)。 試劑:按 HZ-HJ-SZ-0108《水質化學需氧量的測定 密封催化消解法》、GB/T 641—1994《化學試劑 過二硫酸鉀(過硫酸鉀)》中試劑使用和配制要求執行。
1.2 測定方法
COD 按 HZ-HJ-SZ-0108 進行測定。
K
2S
2O
8 參照 GB/T 641—1994 中硫代硫酸鈉滴定法測定, 原理:K
2S
2O
8 在酸性溶液中具有強氧化性,可將碘離子氧化成碘單質。 吸取 5 mL 稀釋過的
K
2S
2O
8 溶液放入 150 mL 干燥碘量瓶中,加入 30 mL
水、1 g 碘化鉀, 搖勻, 在暗處放置 30 min。 加入
2 mL 乙酸(體積分數 36%),用硫代硫酸鈉標準溶液
(0.05 mol/L)滴定。 近終點時,加入 2 mL 淀粉指示液(10 g/L),繼續滴定**溶液藍色消失,同時作空白實驗和原水樣背景實驗。 反應式如下:
S
2O
82-+2I
-=I
2+2SO
42- (1)
2S
2O
32-+I
2=S
4O
62-+2I
- (2)
上述方法適用于測定過程中不產生硫酸根自由基的待測水樣。 若待測水樣中可能存在能將碘離子氧化成碘單質的其他物質, 用硫代硫酸鈉滴定法測定 K
2S
2O
8 可能會造成測定值高于實際值。 硫酸根自由基與其他物質反應生成 SO
42-,采用離子色譜法測定待測水樣中的 SO
42-濃度, 可間接得到剩余 K
2S
2O
8
濃度,同時須扣除原水樣中 SO
42-背景濃度。
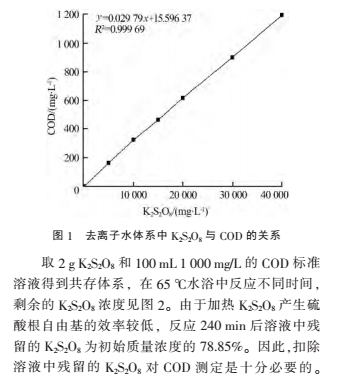
2 結果與討論
2.1 K
2S
2O
8 質量濃度與 COD 的關系
用去離子水配制不同質量濃度的 K
2S
2O
8 溶液,測定其對應的 COD,結果如圖 1 所示。 顯然,K
2S
2O
8質量濃度與 COD 之間呈現顯著的線性關系,得到線性方程為:y=0.029 79x+15.596 37,R
2 為 0.999 69。
結合圖 1 分析,1 mg K
2S
2O
8 對 COD 變化值的貢
獻為 0.029 79 mg。
2.1 水樣中K
2S
2O
8 對 COD 變化值的貢獻
在 去離子水體系中 K
2S
2O
8 質量濃度與其造成的 COD 變化量呈顯著的正相關關系。而 K
2S
2O
8 雖比
較穩定,但在高溫條件下能分解產生硫酸根自由基,
或與水中的還原性物質發生化學反應。 且實際廢水體系成分復雜, 與 K
2S
2O
8 之間的反應更為復雜,因此需考察 K
2S
2O
8 質量濃度與 COD 的對應關系在成分復雜的水樣中是否依然成立, 來決定 2.1 的線性方程是否能用于分析實際水樣。 分別選取 COD 標準溶液體系、 經生化處理后的垃圾滲濾液體系作為研究對象, 投加不同劑量的 K
2S
2O
8, 測定水樣中殘留 K
2S
2O
8 質量濃度及其 COD,借此分析殘留 K
2S
2O
8 對實際水樣 COD 測定結果的影響。
(1)COD 標準溶液體系。 在 50 mL COD 標準溶液中( 理論 COD 為 1 000 mg/L) 投加不同劑量的K
2S
2O
8,測定其 COD,結果見表 1。 在 COD 標準溶液體系中,K
2S
2O
8 的引入導致溶液 COD 相應的升高。由表 1 回收率可知,在消解(165 ℃)之前,K
2S
2O
8 和重鉻酸鉀通過反應消耗完全。 因此在消解過程中不會出現 K
2S
2O
8 產生硫酸根自由基降解 COD 標準溶
|
液從而影響測定結果的情況 |
|
|
|
|
|
|
。 |
|
|
|
|
|
|
2- 加熱 |
- |
(3) |
|
|
|
S2O8 →2SO4· |
|
表 1 |
加入 K2S2O8 后 COD 標準溶液的 COD |
|
K2S2O8 質量濃 加標量/ |
測定值/ |
加標后理論 |
回收 |
|
|
度/(mg·L-1) |
(mg·L-1) |
(mg·L-1) |
值/(mg·L-1) |
率/% |
|
5 000 |
1 000 |
1 144.68 |
1 148.15 |
99.69 |
|
|
10 000 |
1 000 |
1 295.88 |
1 296.30 |
99.96 |
|
|
15 000 |
1 000 |
1 446.97 |
1 444.45 |
100.17 |
|
|
20 000 |
1 000 |
1 600.43 |
1 592.60 |
100.49 |
|
|
30 000 |
1 000 |
1 900.53 |
1 888.90 |
100.62 |
|
|
40 000 |
1 000 |
2 190.05 |
2 185.20 |
100.22 |
|
設含 K
2S
2O
8 的 COD 標準溶液 COD 為 c
1,COD標準溶液的 COD 為 c
0, COD
1=c
1-c
0; 通過 2.1 線性
|
方程計算 K2S2O8 |
對 COD 變化值的貢獻為 |
COD2。 |
|
在 COD 標準溶液體系中對 |
|
COD1、 COD2 |
進行比 |
|
較,結果見圖 3。 |
由圖 3 發現 COD1 |
與 COD2 差值 |
|
較小 |
約為 |
8.76~19.87 mg/L, |
為 |
COD |
標準溶液 |
COD |
|
|
|
, |
|
|
|
|
|
|
的 |
0.88%~1.99% |
。 |
由此說明在 |
COD |
標準溶液體系 |
|
|
|
|
|
|
|
|
|
中 |
, |
該線性方程能較好地反映 |
COD |
的實際差異 |
。 |
|
|
|
|
|
|
|
|
|
|
|
(2)垃圾滲濾液體系。在生化處理后的垃圾滲濾液體系中投加一定量的 K
2S
2O
8, 考察殘留 K
2S
2O
8 引
起的 COD 變化情況。 由于垃圾滲濾液體系成分復雜,可能存在能與 K
2S
2O
8 反應的物質, 因此對反應 180 min 后垃圾滲濾液中剩余的 K
2S
2O
8 進行測定,結
果見表 2。 由表 2 可得,生化處理后的垃圾滲濾液體系中反應 180 min 后殘留的 K
2S
2O
8 與實際投加K
2S
2O
8 **大差值為實際投加量的 6.56%, 說明在該體系中 K
2S
2O
8 沒有明顯分解。 K
2S
2O
8 一般在催化劑存在下才容易分解, 在常規條件下也不表現出較強的氧化性。 而在所有水樣中測得的 K
2S
2O
8 都存在一定程度的降低, 可能是因為垃圾滲濾液中存在極少對 K
2S
2O
8 有催化作用的 Fe
2+等過渡金屬離子, 與其發生反應產生硫酸根自由基
〔6〕:
|
|
n+ |
2- |
(n+1)+ |
- |
2- |
(4) |
|
|
Me +S2O8 =Me |
+ SO·4+SO4 |
|
表 2 |
滲濾液體系加入K2S2O8 前后的K2S2O8 質量濃度變化 |
|
|
|
|
|
|
|
|
|
|
|
項目 |
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
加入K2S2O8/(mg·L-1) |
40.0 |
60.0 |
90.0 |
120.0 |
150.0 |
|
|
3 h 后K2S2O8/(mg·L-1) |
37.8 |
56.6 |
84.1 |
113.9 |
142.2 |
|
注:垃圾滲濾液中可能存在能將碘離子氧化成碘單質的物質,因此該 K
2S
2O
8 質量濃度扣除空白實驗的同時也應扣除垃圾滲濾液水樣背景。
向垃圾滲濾液體系中投加不同劑量的 K
2S
2O
8 會導致體系的 COD 相應升高,結果見表 3。
|
表 3 |
投加 K2S2O8 后垃圾滲濾液體系的 COD |
|
K2S2O8 質量濃 滲濾液/ |
測定值/ |
加標后理論 |
回收 |
|
度/(mg·L-1) |
(mg·L-1) |
(mg·L-1) |
值/(mg·L-1) |
率/% |
|
5 000 |
535.26 |
680.49 |
683.41 |
99.57 |
|
10 000 |
535.26 |
825.99 |
831.51 |
99.33 |
|
15 000 |
535.26 |
972.10 |
979.71 |
99.22 |
|
20 000 |
535.26 |
1 140.06 |
1 127.86 |
101.08 |
|
30 000 |
535.26 |
1 414.52 |
1 424.16 |
99.32 |
|
40 000 |
535.26 |
1 703.99 |
1 720.46 |
99.04 |
設含 K
2S
2O
8 的垃圾滲濾液 COD 為 c
1,垃圾滲濾液的 COD 為 c
0, COD
1=c
1-c
0; 通過 2.1 線性方程計算 K
2S
2O
8 對 COD 變化值的貢獻為 COD
2。 圖 4 比較了垃圾滲濾液體系中 COD
1 與 COD
2, 發現
COD
1 與 COD
2 差異較小, 約為 6.60~38.47 mg/L,為垃圾滲濾液 COD 的 1.23%~7.18%。 說明在成分較
為復雜的垃圾滲濾液體系中,2.1 的線性方程也能較好地反映 COD 的實際差異。2.3 測定體系中 COD 與 TOC 的比較
TOC 表示水中總有機碳含量,是以碳量表征水
體中有機物質總量的綜合指標,所有含碳物質如苯、吡啶等芳香烴類有毒有害物質均能反映在 TOC 指
標中。分別向 COD 標準溶液和垃圾滲濾液體系中加入不同劑量的 K
2S
2O
8,在 65 ℃水浴中反應 300 min,測定溶液的 COD 和 TOC,結果如圖 5、圖 6 所示。 在 65 ℃下過硫酸鉀產生硫酸根自由基, 對 COD 標準
溶液降解效果較好,COD、TOC 的**高去除率分別為
97.49%、97.46%; 其對垃圾滲濾液的處理效果也較好,COD、TOC 的**高去除率達到 96.15%、95.33%。
通過對比不難發現, 由于殘留的 K
2S
2O
8 對 COD 測定造成影響, 沒有扣除 K
2S
2O
8 干擾的 COD 不能準確反映處理效果; 而扣除 K
2S
2O
8 干擾后的 COD 和 TOC 曲線符合理論處理效果,即隨著 K
2S
2O
8 質量濃度的增加,去除率隨之升高。
造成二次污染, 且測定時間較長。 而采用儀器分析
TOC,測樣時間短 ,且目前很多 TOC 測定儀都采用自動進樣系統,自動化程度較高。 由于 COD 表征的
是水體中的有機物和部分無機還原物質被氧化需要的氧化劑用量, 一定程度上不能排除無機還原物質的干擾。 因此對于標準樣品或實際樣品,測定 TOC 的精密度、準確度均比 COD 高;在測定有機污染物含量較低的水樣時,COD 的測定結果誤差較大。 鑒于 TOC 測定方法簡單、準確且沒有試劑污染,建議采用TOC 來代替 COD。
3 結論
(1)去離子水中 K
2S
2O
8 質量濃度與 COD 之間呈現顯著的線性關系,1 mg K
2S
2O
8 對 COD 變化值的貢獻為 0.029 79 mg。 將 K
2S
2O
8 加入 COD 標準溶液和垃圾滲濾液體系中會引起體系 COD 相應的升高。(2)通過計算得出 COD
1 和 COD
2 之間的差異,在生化處理后的垃圾滲濾液體系中其差值為 6.60~ 38.47 mg/L,為原滲濾液 COD 的 1.23%~7.18%。 說明
K
2S
2O
8質量濃度與 COD 之間的線性方程能較好地反映COD 的實際差異。 由線性方程 y=0.029 79x+ 15.596 37, 在測定 COD 前計算出 K
2S
2O
8 引起的
COD
2,可以消除其對 COD 測定引起的干擾。(3)測定水浴反應(65 ℃ ) 后 COD 標準溶液的 COD 和TOC, 扣除 K
2S
2O
8 干擾后的 COD 和 TOC 曲線均能較準確地反映處理效果。 由于 TOC 測定方法簡單準確且沒有試劑污染,更適于評價處理效果。
與 TOC 測定相比較,采用重鉻酸鉀法測定 COD
需使用 Ag
2SO
4 作為催化劑,若水樣中含有較高的氯離子還需使用 HgSO
4 作掩蔽劑,這些試劑的使用易
